Sejarah Penyusunan Sistem Periodik Unsur (SPU)
Mengenal Sejarah Penyusunan Sistem Periodik Unsur (SPU)
Unsur yang dikenal di dunia sampai sekarang ini jumlahnya
mencapai sekitar 118 unsur, termasuk unsur alami dan unsur buatan. Karena
jumlahnya yang banyak, tentu akan sulit untuk menghafalkannya. Karenanya, para
ilmuwan sejak dulu berusaha untuk dapat mengelompokkannya. Pengelompokkan ini
bertujuan untuk mempermudah dalam menghafal seta megnenali berbagai unsur yang
ada.
Pengelompokkan
unsur dilakukan dengan membandingkan sifat-sifat unsur. Usaha pengelompokkan
sistem periodik unsur telah dimulai sejak abad ke-18. Awalnya, unsur ditemukan
dan dipelajari secara terpisah. Namun ketika penemuan unsur semakin banyak, ini
menyulitkan pada ilmuwan untuk mempelajarinya. Karenanya, ilmuwan Arab dan
Persia di akhir abad ke-18, melakukan penggolongan unsur ke dalam logam dan
nonlogam. Kala itu, hanya dikenal sekitar dua puluh jenis unsur yang tampaknya
memiliki sifat berbeda satu sama lain.
Berikut adalah
dasar penggolongan atau sifat-sifat
fisika logam dan nonlogam
Sifat fisika
logam
|
Sifat fisika
nonlogam
|
1. Mengilap.
2. Pada suhu
kamar umum-
nya berwujud
padat.
3. Mudah
ditempa/dibentuk.
4. Penghantar
panas dan
listrik yang
baik.
|
1. Tidak
mengilap.
2. Pada suhu
kamar dapat
berwujud padat,
cair, dan
gas.
3. Sulit dibentuk
dan rapuh.
4. Bukan
penghantar panas dan listrik yang baik.
|
Seorang ilmuwan lain, Lavoisier masih menganggap cahaya dan kalori sebagai zat/unsur dan beberapa senyawa sebagai unsur. Karenanya, tidak puas dengan penggolongan unsur logam dan nonlogam saja, Lavoisier membagi unsur berdasarkan sifat kimia zat-zat menjadi gas, logam, nonlogam, dan tanah.
Perkembangan baru kemudian terjadi dengan ditandai oleh penemuan teori atom oleh John Dalton. Pada awal abad ke-20, Dalton menemukan bahwa setiap unsur mempunyai sifat dan massa atom yang berbeda. Massa atom yang dimaksud adalah perbandingan massa atom unsur tersebut terhadap massa atom unsur hidrogen. Dalton kemudian mengelompokkan 36 unsur yang ada saat itu berdasarkan kenaikkan massa atomnya. Meski kemudian penentuan massa atom tersebut salah.
Sebagai gantinya, mereka menggunakan massa atom relatif, yaitu perbandingan massa atom yang satu terhadap atom lain. Metode penentuan massa atom relatif ini merupakan ide dari Berzelius (1814) dari Swedia serta P. Dulong dan A. Petit (1819) dari Perancis. Mereka bertiga menggunakan kalor jenis unsur untuk menentukan massa atom relatif. Massa atom relatif menjadi sifat penting bagi unsur dan merupakan sifat spesifik. Ini karena setiap unsur mempunyai massa atom relatif tertentu yang berbeda dari unsur lainnya.
Penemuan spektrometer massa pada awal abad XX, membuat penentuan massa atom kembali mengalami perubahan. Unsur hidrogen tidak lagi menjadi pembanding, melainkan isotop C-12. Selain itu, satuan yang digunakan bukan lagi gram melainkan satuan massa atom (sma).
Hanya saja, satuan massa atom (sma) terlalu kecil sehingga tidak ada neraca di dunia yang mampu menimbang massa atom. Lalu, berdasarkan hasil penghitungan massa atom ini Berzellius mempublikasikan daftar massa atom unsur-unsur yang lebih akurat.
Selanjutnya, pada ahli pun terus melakukan pengelompkkan sistem periodik unsur hingga ditemukan sistem pengelompokkan modern sekarang ini. Berikut beberapa penemuan dalam PERKEMBANGAN SISTEM PERIODIK UNSUR:
1. Hukum Triade Dobereiner
Pada tahun 1829, Johan Wolfgang Dobereiner, seorang professor kimia dari Jerman, mengelompokkan unsur-unsur berdasarkan kemiripan sifat. Masing-masing kelompok terdiri atas 3 unsur (triad). Dobereiner menemukan adanya kecenderungan bahwa massa atom unsur yang di tengah merupakan rata-rata massa atom 2 unsur yang mengapit. Hal ini diawali dari pengamatannya terhadap massa atom relatif Stronium yang ternyata sangat dekat dengan massa rata-rata dari dua unsur lain yang mirip dengan strontium, yaitu Kalsium dan Barium. Hal ini pun juga terjadi pada beberapa kelompok unsur lain.
Hal inilah yang mendasari pembentukan kelompok Triad. Misalnya saja pada kelompok Li, Na dan K, dimana massa atom relatif Na (23) adalah rata-rata dari Li (7) dan K (39). Namun, sistem Triade Doberainer akhirnya gugur karena tidak ada cukup banyak Triade yang mampu ditemukan. Meskipun demikian, Dobereiner adalah pelopor pertama yang berusaha melakukan penggolongan pada unsur.
2. Hukum Oktaf Newlands
Triade Dobereiner mendorong John Alexander Reina Newlands, seorang ahli kimia dari Inggris untuk melanjutkan upaya pengelompokan unsur-unsur berdasarkan kenaikkan massa atom dan kemiripan sifat unsur. Pada tahun 1866, Newlands mengamati adanya pengulangan secara teratur keperiodikan sifat unsur ketika unsur-unsur itu disusun berdasarkan pada urutan kenaikan massa atomnya. Pengulangan ini berlangsung pada tiap unsur ke delapan. Misalnya unsur ke-8 memiliki kemiripan sifat dengan unsur ke-1, dan juga unsur ke-9 yang mirip sifatnya dengan unsur ke-2.
Sifat keperiodikan unsur berdasarkan urutan kenaikan massa atom setiap kelipatan delapan ini disebut sebagai hukum oktaf. Ketika itu, jumlah unsur yang ditemukan hanya 60 unsur. Gas mulia belum ditemukan sehingga tidak termasuk dalam pengelompokan sistem oktaf.
Berikut pengelompokan unsur berdasarkan
hukum oktaf Newlands:
1
|
H
|
F
|
Cl
|
Co/Ni
|
Br
|
Pd
|
I
|
Pt
|
2
|
Li
|
Na
|
K
|
Cu
|
Rb
|
Ag
|
Cs
|
Tl
|
3
|
Be
|
Mg
|
Ca
|
Zn
|
Sr
|
Cd
|
Ba/V
|
Pb
|
4
|
B
|
Al
|
Cr
|
Y
|
Ce/La
|
U
|
Ta
|
Th
|
5
|
C
|
Si
|
Ti
|
In
|
Zr
|
Sn
|
W
|
Hg
|
6
|
N
|
P
|
Mn
|
As
|
Di/Mo
|
Sb
|
Nb
|
Bi
|
7
|
O
|
S
|
Fe
|
Se
|
Ro/Ru
|
Te
|
Au
|
Os
|
Beberapa unsur ditempatkan tidak urut sesuai massanya, serta ada dua unsur ditempatkan di kolom yang sama karena kemiripan sifat.
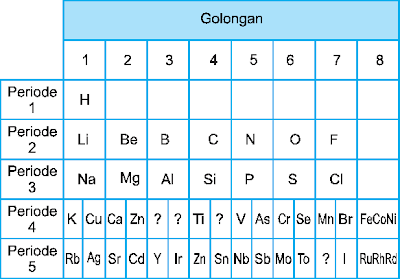
3. Sistem Periodik Mendeleyev
Pada tahun 1869, Dmitri Ivanovich Mendeleyev, ahli kimia Rusia menyusun 65 unsur yang ada. Sesuai kegemarannya bermain kartu, Mendeleyev mengumpulkan informasi sebanyak-banyaknya tentang unsur, dan menuliskannya pada kartu-kartu. Kartu-kartu unsur tersebut lalu disusun berdasarkan kenaikan massa atom dan kemiripan sifat kimianya. Kartu unsur dengan sifat mirip terletak pada kolom yang sama yang kemudian disebut golongan. Sedangkan pengulangan sifat menghasilkan baris yang disebut periode.
Mendeleyev juga menyediakan kotak kosong untuk tempat unsur yang belum ditemukan saat itu, seperti unsur bernomor massa 44, 68, 72, dan 100. Mendeleyev meramalkan sifat-sifat unsur tersebut yang kemudian ramalannya terbukti ketika unsur-unsur tersebut ditemukan. Susunan unsur berdasarkan hukum Mendeleyev ini lalu disempurnakan dan disebut dengan sistem periodik Mendeleyev.
Di saat bersamaan, Julius Lothar Meyer juga membuat susunan unsur yang serupa. Bedanya, Meyer menyusun unsur-unsur tersebut berdasarkan sifat fisiknya. Meskipun dasar yang digunakan berbeda, namun ternyata pengelompokan unsur yang dihasilkan sama.
Berikut adalah
tabel sistem periodik Mendeleyev:
- Dapat meramalkan tempat kosong untuk unsur yang belum ditemukan (diberi tanda ?), seperti pada unsur Eka-silikon (Germanium-Ge) berada di antara Si dan Sn.
- Menyajikan data massa atom secara lebih akurat, seperti Be dan U.
- Periode 4 dan 5 mirip dengan Sistem Periodik Modern, seperti pada unsur K dan Cu yang sama-sama berada di periode 4 golongan I. Dalam Sistem Periodik Modern K digolongan IA dan Cu di golongan IB.
- Penempatan gas mulia yang baru ditemukan tahun 1890 –1900 tidak merubah susunan Sistem Periodik Mendeleyev.
Meski demikian, sistem ini mempunyai kelemahan seperti adanya penempatan unsur yang tidak sesuai dengan kenaikkan massa atom. Seperti pada 127I dan 128Te, yang karena sifatnya, Mendeleyev terpaksa menempatkan Te lebih dulu daripada I. pada sistem Periodik Modern yang berdasarkan pada kenaikkan nomor atom Te (Z = 52) lebih dulu dari I (Z = 53).
Baca juga: Sifat - Sifat Periodik Unsur
4. Pengelompokan Unsur Berdasarkan Sistem Periodik Modern
Pada tahun 1913, Henry Moseley menemukan bahwa urutan kenaikkan nomor atom cenderung diikuti dengan kenaikan massa atomnya. Moseley menyimpulkan bahwa keperiodikan sifat fisika dan kimia unsur disusun berdasar pada nomor atomnya. Penemuan inilah yang kemudian memunculkan sistem periodik modern dari unsur. Pada Sistem Periodik Modern ditemukan keteraturan pengulangan sifat dalam periode (baris) serta kemiripan sifat dalam golongan (kolom).
Sistem periodik unsur modern ini merupakan modifikasi dari sistem periodik Mendeleyev. Mendeleyev telah meletakkan dasar yang memungkinkan perkembangan sistem periodik unsur. Setelah penemuan unsur-unsur gas mulia, sistem Mendeleyev ini lalu dikembangkan dan disempurnakan oleh Moseley.
Pada tampilan fisik tabel Sistem Periodik Modern, terdapat periode yang dibedakan menjadi periode pendek dan periode panjang, serta golongan yang dibedakan menjadi golongan A (golongan utama) dan golongan B (golongan transisi). Pada periode pendek mencakup periode 1 (terdiri dari 2 unsur), periode 2 (terdiri dari 8 unsur) dan periode 3 (terdiri dari 8 unsur). Pada periode panjang terdapat periode 4 sampai dengan periode 7.
a. Golongan
Penyusunan golongan unsur pada
sistem periodik unsur modern didasarkan pada jumlah elektron valensi (elektron yang terletak pada kulit terluar). Unsur
dalam satu golongan mempunyai sifat yang cenderung sama dan ditempatkan dalam arah vertikal (kolom).
Sistem periodik unsur modern,
terdari dari golongan yang dibagi menjadi 18 berdasarkan aturan IUPAC. Merujuk
pada aturan Amerika, sistem periodik unsur modern dibagi ke dalam dua golongan
yakni golongan A dan B. Golongan unsur dari kiri ke kanan yaitu:
IA, IIA, 11113, IVB, VB, VIB, VIIB,
VIIIB, IB, 1113, IIIA, IVA, VA, VIA, VIIA, dan VIIIA. Dalam sistem ini juga digunakan
pembagian golongan menjadi A dan B.
Golongan yang ada pada sistem periodik
unsur modern, diberi nama khusus. Berikut adalah penggolongannya dan contoh
nama khusus serta unsur-unsurnya:
Golongan
|
Nama
Khusus
|
Unsur-unsur
|
|
IA
|
1
|
Alkali
|
Li,
Na, K, Rb, Cs, dan Fr
|
IIA
|
2
|
Alkali
Tanah
|
Be,
Mg, Ca, Sr, Ba, dan Ra
|
IIIA
|
13
|
Boron
|
B,
Al, Ga, In, dan Tl
|
IVA
|
14
|
Karbon
|
C,
Si, Ge, Sn, dan Pb
|
VA
|
15
|
Nitrogen
|
N,
P, As, Sb, dan Bi
|
VIA
|
16
|
Oksigen
|
O,
S, Se, Te, dan Po
|
VIIA
|
17
|
Halogen
|
F,
Cl, Br, I, dan At
|
VIIIA
|
18
|
Gas
Mulia
|
He,
Ne, Ar, Kr, Xe, dan Rn
|
b. Periode
Periode unsur pada sistem periodik
unsur modem disusun pada arah horisontal (baris) guna
menunjukkan kelompok unsur dengan jumlah kulit yang sama.
Sistem periodik bentuk panjang
terdiri dari 7 periode, yakni :
1) periode pendek, meliputi:
a)
periode 1
terdiri atas 2 unsur; (periode sangat pendek, unsurnya
hanya H dan He)
b)
periode 2
terdiri atas 8 unsur;
c)
periode 3 terdiri atas 8 unsur.
2) periode panjang, meliputi:
a)
periode 4
terdiri atas 18 unsur;
b)
periode 5
terdiri atas 18 unsur;
c)
periode 6 terdiri atas 32 unsur.
d)
periode 7 terdiri dari periode
yang unsur-unsurnya belum lengkap berisi 30 unsur
Unsur dalam periode 6 termasuk
periode yang sangat panjang, karena berisi 32 unsur.
Golongan III B pada periode 6 berisi
14 unsur dengan sifat mirip yang dinamakan sebagai golongan lantanida.
Pada golongan III B pada periode 7
berisi 14 unsur dengan sifat mirip yang dinamakan sebagai golongan aktinida.
Golongan lantanida dan aktinida ini
disebut sebagai golongan transisi dalam.
Penulisan umum unsur golongan
aktinida dan lantanida dituliskan terpisah di bawah.
Penetapan Golongan
dan Periode
Penetapan golongan dan periode dapat
dilakukan dengan cara menuliskan konfigurasi elektron. Yang dimaksud dengan konfigurasi
elektron merupakan penataan elektron dalarn atom yang ditentukan berdasarkan
jumlah elektron. Pada konfigurasi elektron, jumlah elektron valensi menunjukkan
nomor golongan, sedangkan jumlah kulit yang sudah terisi dengan elektron (n
terbesar) menunjukkan periode.
APAKAH SOBAT ELmoE SUSAH MENGHAFAL SPU? YUK SIMAK JUGA CARA MENGHAFAL SPU..
 |
| daftar sistem periodik unsur |
Referensi:
Harnanto, Ari. 2009. Kimia 1 : Untuk SMA/MA Kelas X. Jakarta
: Pusat Perbukuan, Departemen Pendidikan Nasional.